Fluoreszenzenzpolarisation
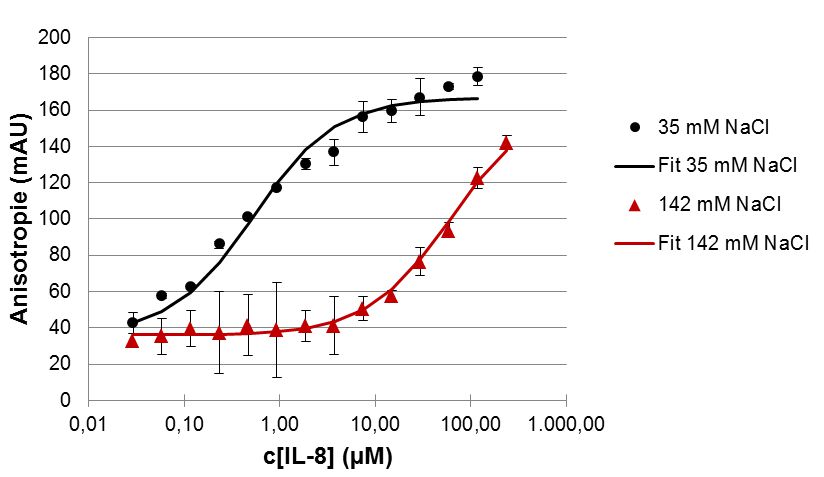
Werden Fluorophore mit polarisiertem Licht angeregt, so strahelen sie auch polarisiertes Licht ab. Die Polarisation ist dabei an Maß für die Begeglichkeit des Fluorophors. Auf diese Weise kann der Anteil freier, also beweglicher, fluoreszenzmarkierter Liganden und der Anteil proteingebundener, weniger beweglicher Liganden im Gleichgewicht bestimmt werden, ohne dass die beiden Spezies getrennt werden müssten. Auf diese Weise lassen sich Bindungskurven vermessen und Dissoziationskonstanten bestimmen. Abbildung 1 zeigt die Bindung eines fluoreszenzmarkierten Rezeptorpeptids aus CXCR1 an das Chemokin Interleukin-8. Da die beiden Bindungspartner zahlreiche, bei neutralem pH geladene Seitenketten ausweisen, ist die Bindung stark vom Salzgehalt der Lösung abhängig.
Chemotaxisassays
Die Migration in Richtung steigender Chemokinkonzentration (Chemotaxis) ist eine wichtige Reaktion von Leukozyten auf Chemokine. Im sogenannten Transwell-Assay werden isolierte humane Neutrophile in ein Gefäß gegeben, dass über einen Polycarbonatfilter mit einer darunterliegenden Kammer verbunden ist, in der sich eine Chemokinlösung befindet. Das Chemokin kann in die obere Kammer diffundieren und löst die Wanderung der Zellen durch die Poren der Membran aus. Die Anzahl der Zellen, die nach einer gegebenen Zeit in die untere Kammer gelangt sind, ist ein Maß für die Aktivität des Chemokins oder dafür, wie ein hinzugegebener Inhibitor diese Aktivität verringert.



