Molekulare Kartographierung des Immunophilin-Glucocorticoid-Rezeptor-Komplexes Interaktion zeigt Schlüsselschritt der humanen Stressantwort
10.11.2023 von F. Hausch
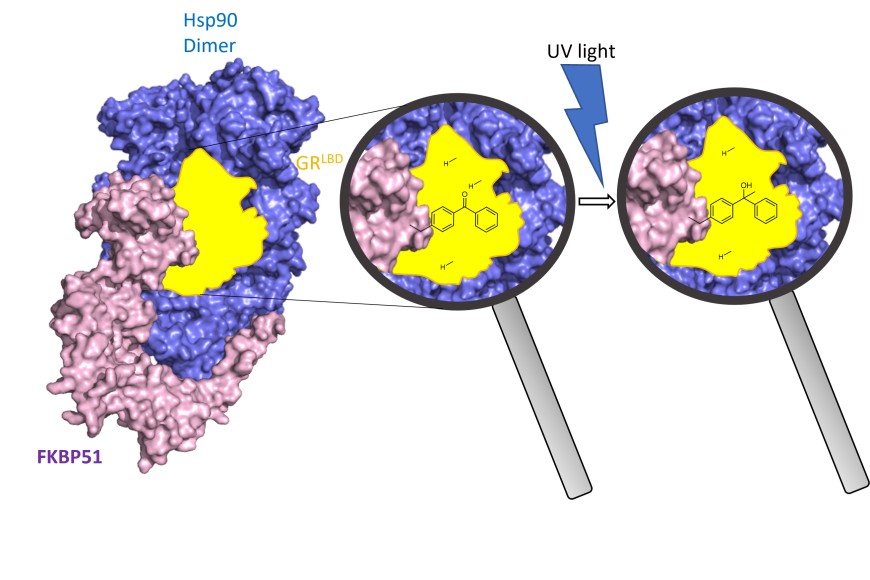
Stress- und Hormonsignale werden molekular von Steroidhormonrezeptoren verarbeitet, die wiederum von den regulatorischen Proteinen FKBP51 und FKBP52 gesteuert werden. Diese Proteine spielen eine Schlüsselrolle bei stressbedingten Störungen bzw. bei der korrekten Embryonalentwicklung. Wie FKBP51 und FKBP52 auf Steroidhormonrezeptoren wirken, ist unbekannt.
In einer aktuellen Veröffentlichung in der renommierten Zeitschrift Nature Structural and Molecular Biology hat die Arbeitsgruppe um Prof. Felix Hausch die Architektur und Funktionsweise von FKBP51 und FKBP52 im Komplex mit dem Glucocorticoidrezeptor und dem Chaperon Hsp90 aufgeklärt. „Durch den systematischen Einbau photoreaktiver Aminosäuren konnten wir erstmals direkte Kontakte von FKBP51 und FKBP52 mit dem Glucocorticoidrezeptor in lebenden menschlichen Zellen abbilden“, erklärt Asat Baischew, Erstautor der Veröffentlichung. „Dies ermöglicht es uns, eine Momentaufnahme des Glucocortoidrezeptors in dem bisher schwer fassbaren Zustand vor der Aktivierung zu rekonstruieren, der für die Regulierung durch FKBPs entscheiden ist“, fügt Sarah Engel, zweite Schlüsselauthorin der Publikation, hinzu. Diese Studien, die teilweise vom LOEWE-Konsortium TRABITA finanziert wurden, zeigen, wie FKBP51 und FKBP52 unterschiedlich mit dem Glucocorticoidrezeptor interagieren, erklären die differenzielle Pharmakologie von FKBP51-Liganden und liefern eine strukturelle Grundlage für die Entwicklung von FKBP-Liganden mit höherer Wirksamkeit. Dies eröffnet neue Ansätze für die Entdeckung verbesserter Medikamente gegen Depressionen, diabetesbedingte Fettleibigkeit oder chronische Schmerzen.
